現如今,催化反應機理研究是高水平論文必不可少的組成部分(fēn)。大(dà)家已經不僅僅滿足于簡單的“構效關系”,還希望把連接“構”和“效”之間的黑盒子打開(kāi),理解導緻這種“構效關系”的内在機制,也就是所謂的反應機理。近十年來,原位漫反射紅外(wài)光譜、原位拉曼光譜、近常壓X射線光電(diàn)子能譜、原位X射線衍射譜、原位X射線吸收譜、原位穆斯堡爾譜、原位電(diàn)鏡等原位表征技術得到了極大(dà)的發展,也越來越頻(pín)繁得出現在期刊論文上。研究人員(yuán)無比青睐這種“所見即所得”的實驗研究技術。隻要建立起完整的标準數據庫,無論是作者還是讀者都很方便、直觀得得到結論。現在的各種技術在壓力、溫度、傳質、傳熱上無法完全複現真實的催化反應過程,導緻很可能出現原位表征數據與實驗結論大(dà)相徑庭。此外(wài),現在的研究者對機理的研究越來越多得依賴于原位表征這種“直接”“暴力”的手段。原位表征也逐漸成爲了科研的研究“範式”。然而,早期科學家那種讓人“眼前一(yī)亮”的實驗設計卻越來越少。本文将列舉從早期到如今的經典文獻,學習一(yī)下(xià)科學家們巧妙的實驗設計思路,希望對讀者未來的催化機理研究有所啓發。
(一(yī))費(fèi)托合成反應機理研究
費(fèi)托合成(FTS)反應機理多種多樣,最爲廣泛接受的是如下(xià)三種機理(表1)。這三種機理是按照聚合的單體(tǐ)以及鏈起始物(wù)種進行的分(fēn)類。如何驗證某個反應體(tǐ)系屬于哪一(yī)種機理呢?從原位表征的角度來看,最簡單的方式就說通過原位手段探測到亞甲基(CH2)、羟基卡賓(CHOH)和非解離(lí)吸附的CO,從而判斷反應路徑。但在沒有這些表征手段的過去(qù),科學家們卻通過巧妙的實驗驗證了這些機理。
Robert C. Brady III和R. Pettit教授通過CH2N2實驗證明了FTS走的是碳化物(wù)機理[1,2]。CH2N2是用來提供亞甲基單體(tǐ)。(1)當他們通CH2N2和N2的混氣時,主産物(wù)是乙烯,并沒有得到FTS産物(wù)分(fēn)布。這說明單獨的CH2*無法碳鏈增長,隻能雙聚,證明了CH2無法做FTS的鏈初始物(wù)種。(2)當他們通CH2N2和合成氣的混氣時,産物(wù)可能存在三種情況。如果是CO插入機理,那麽CH2可以加氫成CH3作爲鏈初始物(wù)種,所以産物(wù)産量會增加,但碳鏈分(fēn)布與隻通合成氣時沒有改變。如果是烯醇機理,産物(wù)的碳鏈分(fēn)布會符合CH2+H2和烯醇縮合兩個模型的疊加。如果是碳化物(wù)機理,CH2可以作爲碳鏈增長的單體(tǐ),所以産物(wù)中(zhōng)碳鏈的長度會變長。他們的實驗發現是第三種情況,即碳化物(wù)機理。(3)當他們通同位素标記的混氣(12CH2N2+13CO+H2),并檢測丙烯中(zhōng)C的标記情況時,産物(wù)可能存在以下(xià)幾種情況。如果是CO插入機理,那丙烯隻可能存在兩種情況13C-13C-13C或12C-13C-13C,無論哪種情況,丙烯中(zhōng)13C都不少于60%。因此CO插入機理對應的實驗現象是無論加多少12CH2N2,丙烯中(zhōng)13C都不少于60%。如果是烯醇機理,那丙烯會是13C-13C-13C和12C-12C-12C的混合物(wù)。如果是碳化物(wù)機理,則各種組合都可能存在。後兩種機理的區别在于在通不同比例的12CH2N2和13CO情況下(xià),兩種模型預測出的13C含量不同。最後實驗發現仍然是碳化物(wù)機理。
Ritschel和Vielstich教授用HCl溶解反應後的FTS催化劑,發現溶解過程中(zhōng)産生(shēng)的氣相産物(wù)選擇性與FTS反應中(zhōng)類似,同樣證明了表面碳化物(wù)機理[3]。
Bell教授用環己烯和合成氣混氣作爲反應物(wù),在FTS條件下(xià)反應。産物(wù)中(zhōng)生(shēng)成了降蒈烷(norcarane)和烷基環己烯。說明環己烯與表面生(shēng)成的CH2發生(shēng)了反應,間接證明了碳化物(wù)機理[4]。
(二)判定表面、界面還是頂點是活性位點
在很多催化反應中(zhōng),研究人員(yuán)經常認爲界面是活性位點,但證明方法大(dà)多是理論計算,很難給出直接的、實驗上的證據,這需要單顆粒的空間分(fēn)辨率如單分(fēn)子熒光顯微技術[5]。2013年,Fornasiero和Murray教授通過簡單得改變催化劑尺寸,通過對反應動力學的分(fēn)析,證明了界面處是活性位點[6]。他們的思路很簡單。表面是二維的面、界面是一(yī)維的線、頂點是零維的點。所以對于常規的多面體(tǐ)來說,單位體(tǐ)積内的表面位點數(~d2/d3)正比于d-1,單位體(tǐ)積内的界面位點數(~d/d3)正比于d-2,單位體(tǐ)積内的頂點數(~1/d3)正比于d-3。由于不同尺寸的樣品形貌和晶格常數略有區别,研究人員(yuán)給出了更精确的計算:單位體(tǐ)積内的表面位點數正比于d-0.9,單位體(tǐ)積内的界面位點數正比于d-1.9,單位體(tǐ)積内的頂點數正比于d-2.6(圖1)。研究人員(yuán)再把樣品的轉換頻(pín)率(TOF)畫在圖上,發現TOF與d-2.3成正比,從而說明金屬與載體(tǐ)的界面是活性位點(圖1)。
圖1. 模型分(fēn)析[6]。
(三)氫溢流
氫溢流是各種加氫反應中(zhōng)常常存在的實驗現象,指的是原本無法解離(lí)H2的位點吸附了H,這個位點上的H就說從能夠解離(lí)H2的位點溢流過來的。Sykes教授利用這種現象設計了一(yī)個很有意思的實驗[7]。他們把Pd單原子負載在Cu表面。這時候Pd能夠解離(lí)H2,并且對CO具有很強的吸附能力;Cu表面無法解離(lí)H2,隻能吸附解離(lí)後的H原子,并且對CO吸附能力弱。由于反應的可逆性,H2也隻能在Pd表面脫附而無法在Cu表面脫附。他們先通H2,H2在Pd單原子上解離(lí),并溢流到Cu表面;再通CO,這時候CO會吸附在Pd單原子上,将其毒化。當升溫時,隻有CO脫附之後,才會開(kāi)始脫附H2。
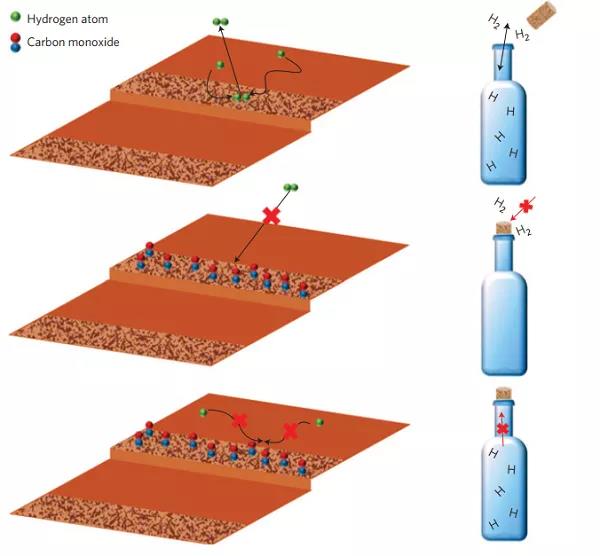
圖2. 分(fēn)子瓶塞效應。
科研探索本身應該是一(yī)個有趣的過程,特别是當你靈光一(yī)現,有了一(yī)個巧妙的實驗構思的時候。用催化實驗來探索反應機理,不僅能夠彌補那些寶貴的原位機時,還能讓你的研究更有藝術性。
文章轉載自微信公衆号:材料人